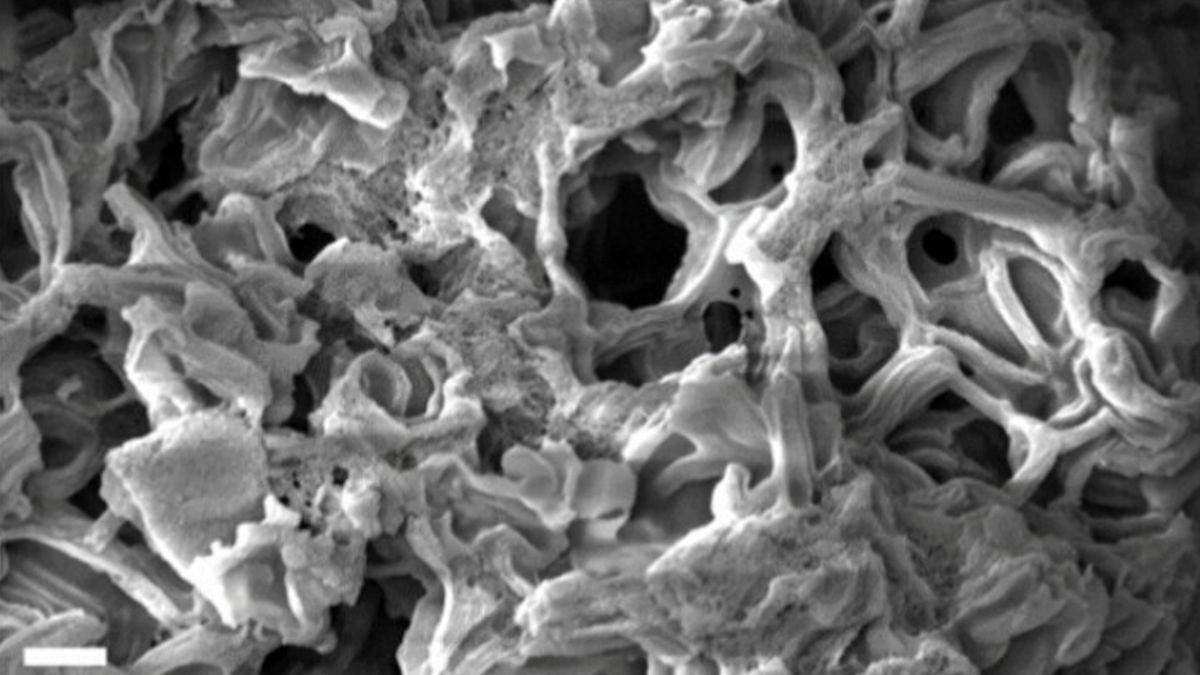
Récord de área superficial: Desarrollo de un carbono nanoporoso con una área superficial de 4.800 metros cuadrados por gramo, la más alta registrada hasta la fecha.
Reacción inspirada en cohetes produce carbono con récord de área superficial
Un equipo de investigadores de la Universidad de Cornell ha desarrollado un carbono nanoporoso con la mayor área superficial jamás registrada, utilizando una reacción química inspirada en la ignición de combustible para cohetes. Este avance ya está mostrando beneficios significativos en la captura de dióxido de carbono y tecnologías de almacenamiento de energía.
Un nuevo enfoque para potenciar la porosidad del carbono
El carbono poroso es fundamental en aplicaciones como la adsorción de contaminantes y el almacenamiento de energía. La clave está en exponer la mayor cantidad posible de superficie del material sin comprometer su estructura. En este caso, los investigadores lograron alcanzar una área superficial de 4.800 metros cuadrados por gramo, el equivalente al tamaño de un campo de fútbol comprimido en una cucharadita de material.
El desafío radica en maximizar la porosidad sin destruir la estructura del material ni reducir su rendimiento práctico. Para ello, Emmanuel Giannelis, profesor del Departamento de Ciencia e Ingeniería de Materiales de Cornell, y el investigador postdoctoral Nikolaos Chalmpes utilizaron reacciones hipergólicas. Estas reacciones, que liberan energía rápidamente al mezclar ciertos químicos, se habían limitado anteriormente a sistemas de propulsión en cohetes y sondas espaciales.
La síntesis del carbono de alta porosidad
El proceso comienza con sacarosa y un material que actúa como plantilla para dar forma al carbono. Al mezclar estos componentes con ciertos químicos, la reacción hipergólica se enciende, formando tubos de carbono con anillos moleculares reactivos de cinco átomos de carbono, en lugar de los seis que son típicos en la mayoría de las estructuras de carbono.
Posteriormente, el material se trata con hidróxido de potasio, que elimina las estructuras menos estables, creando una compleja red de poros microscópicos. Esta técnica permite «atrapar» al material en una configuración metastable que no sería posible con procesos más lentos de calentamiento convencional.
Resultados destacados: captura de carbono y almacenamiento de energía
El material nanoporoso demostró ser capaz de adsorber dióxido de carbono a casi el doble de la capacidad de los carbones activados tradicionales, logrando capturar el 99 % de su capacidad total en solo dos minutos. Este desempeño lo convierte en uno de los adsorbentes más rápidos en su clase.
Además, el material muestra un gran potencial en almacenamiento de energía, logrando una densidad energética volumétrica de 60 vatios-hora por litro, cuatro veces más que los carbones activados comerciales.
Aplicaciones potenciales y futuro del desarrollo
Este avance ofrece una nueva estrategia para diseñar y sintetizar materiales basados en carbono que sean útiles como adsorbentes, soportes catalíticos y materiales activos para supercondensadores, especialmente en aplicaciones donde la eficiencia espacial es crítica.
Las condiciones experimentales únicas de las reacciones hipergólicas también abren nuevas posibilidades para diseñar electrocatalizadores con propiedades mejoradas, lo que podría beneficiar sectores como la producción de energías renovables y la descarbonización industrial.
El estudio fue financiado por el Departamento de Energía de los Estados Unidos, a través del Centro de Soluciones Energéticas Basadas en Alcalinos de Cornell, y por la Fundación Nacional de Ciencias de los Estados Unidos.
Un paso adelante hacia la sostenibilidad
Este avance no solo mejora las tecnologías actuales de captura de carbono y almacenamiento de energía, sino que también representa un hito en la utilización de procesos químicos innovadores para enfrentar los desafíos del cambio climático. Los investigadores continuarán explorando el potencial de estas técnicas en aplicaciones futuras, incluyendo la creación de nuevas aleaciones de nanopartículas y catalizadores.
Vía cornell.edu



Deja una respuesta