La electrólisis es un proceso electroquímico fundamental con aplicaciones diversas en la industria y la investigación científica. En este artículo, exploraremos qué es la electrólisis, su principio de funcionamiento, sus aplicaciones y algunos ejemplos prácticos.
Principio de Funcionamiento
La electrólisis es un proceso que utiliza una corriente eléctrica para inducir una reacción química no espontánea. Este fenómeno ocurre en una celda electrolítica, que consta de dos electrodos (ánodo y cátodo) sumergidos en un electrolito, una solución que contiene iones móviles.
Componentes de la Celda Electrolítica
- Ánodo: Es el electrodo positivo donde ocurre la oxidación.
- Cátodo: Es el electrodo negativo donde ocurre la reducción.
- Electrolito: Es una solución iónica que permite el flujo de iones, completando el circuito eléctrico.
Cuando se aplica una corriente eléctrica a través de los electrodos, los iones en el electrolito se mueven hacia los electrodos opuestos: los cationes se dirigen al cátodo y los aniones al ánodo, permitiendo así que ocurran las reacciones redox.
Reacciones Electroquímicas
Durante la electrólisis, se llevan a cabo reacciones de reducción y oxidación en los electrodos. La reacción global puede dividirse en dos semirreacciones:
Semirreacción de Oxidación (Ánodo)
M→Mn++ne−
Semirreacción de Reducción (Cátodo)
Mn++ne−→M
Donde M representa el material que se oxida o reduce, y nnn es el número de electrones transferidos.
Aplicaciones de la Electrólisis
La electrólisis tiene una amplia gama de aplicaciones en la industria y la investigación. A continuación, se describen algunas de las aplicaciones más comunes:
Producción de Metales
Uno de los usos más conocidos de la electrólisis es en la extracción y purificación de metales. Por ejemplo, la electrólisis se utiliza en la producción de aluminio a partir de la alúmina (óxido de aluminio) en un proceso conocido como el proceso Hall-Héroult.
Electrochapado
El electrochapado es una técnica que utiliza la electrólisis para depositar una capa delgada de metal sobre la superficie de otro material. Esto se utiliza ampliamente para mejorar la resistencia a la corrosión, la apariencia y la dureza de los productos metálicos.
Producción de Cloro y Soda Cáustica
En la industria química, la electrólisis de soluciones de cloruro de sodio (salmuera) se utiliza para producir cloro y soda cáustica (hidróxido de sodio). Estos productos tienen numerosas aplicaciones en la producción de plásticos, papel, detergentes y otros productos químicos.
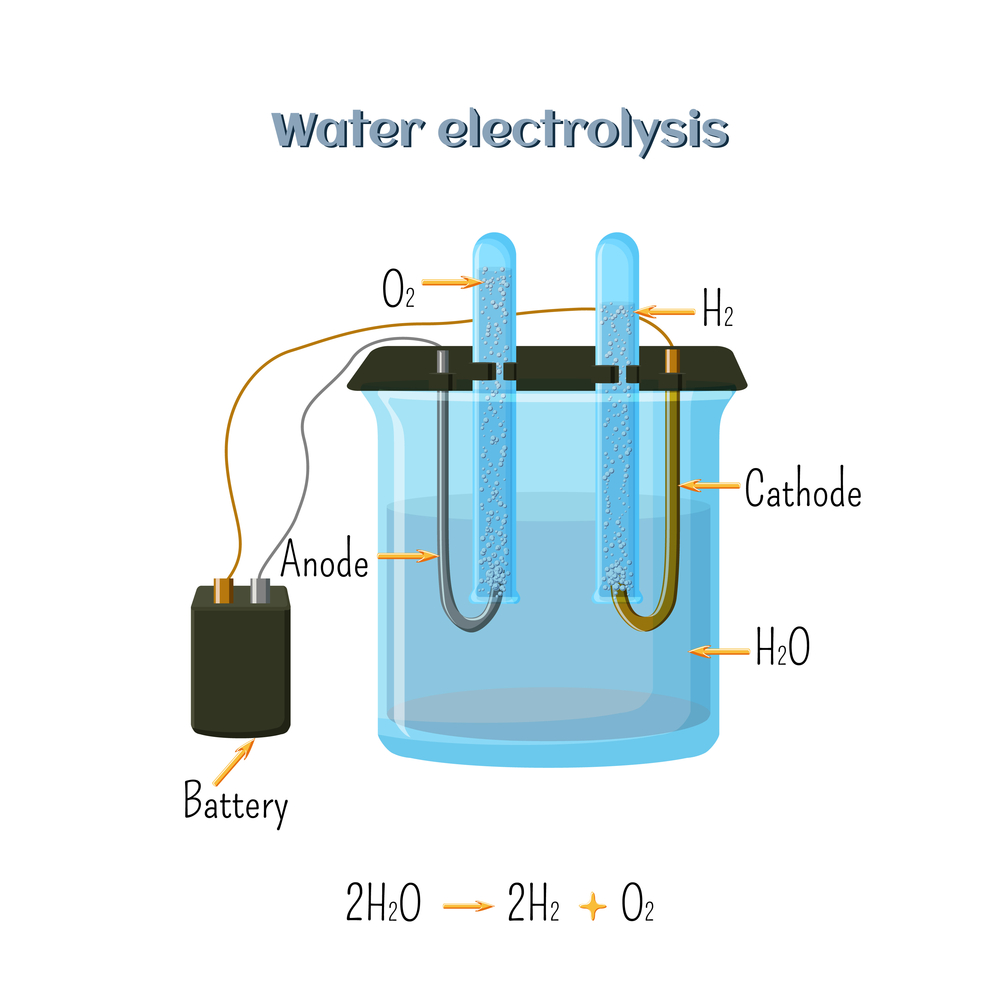
Electrólisis del Agua
La electrólisis del agua es un proceso que descompone el agua en oxígeno e hidrógeno utilizando una corriente eléctrica. Esta tecnología es fundamental para la producción de hidrógeno como fuente de energía limpia y sostenible.
Ejemplos Prácticos
Electrólisis del Agua
Para la electrólisis del agua, se utiliza una celda electrolítica con electrodos de platino o acero inoxidable y una solución de electrolito, como hidróxido de potasio (KOH). La reacción global para la electrólisis del agua es:
2H2O(l)→2H2(g)+O2(g)
Este proceso es de gran interés para la producción de hidrógeno como combustible, especialmente en aplicaciones de energía renovable.
Purificación del Cobre
En la purificación del cobre, se utiliza una celda electrolítica con un ánodo de cobre impuro y un cátodo de cobre puro. La electrólisis permite la transferencia de cobre desde el ánodo al cátodo, eliminando impurezas y produciendo cobre de alta pureza. La reacción es:
Cu2++2e−→Cu
La electrólisis es un proceso electroquímico esencial con aplicaciones diversas en la industria y la ciencia. Desde la producción de metales y químicos hasta la generación de energía limpia, la electrólisis desempeña un papel crucial en el avance tecnológico y la sostenibilidad. Comprender su funcionamiento y aplicaciones nos permite aprovechar al máximo sus beneficios en múltiples campos.



Deja una respuesta